Prognostyczna rola ctDNA u chorych na chłoniaka DLBCL
W ostatnich latach obserwujemy rozwój wiedzy na temat patomechanizmów biorących udział w powstawaniu chorób nowotworowych, co spowodowało równoległy postęp technik molekularnych. Wiele z nich umożliwia dokładną analizę znacznie większej liczby i rodzajów zmian genetycznych na poziomie zarówno DNA, jak i RNA w komórkach nowotworowych. Nowotworowe krążące DNA (ctDNA, ang. circulating tumor DNA) jest innowacyjną, nieinwazyjną metodą, która ma służyć do monitorowania skuteczności leczenia i oceny prognostycznej u chorych na chłoniaki B-komórkowe.
Pierwsze badania oceniające krążące pozakomórkowe DNA (cfDNA, ang. circulating free DNA) były opublikowane już w 1948 roku [1]. W 1977 roku po raz pierwszy opisano, że ilość cfDNA jest znacznie niższa u osób zdrowych w porównaniu z chorymi na nowotwory złośliwe. Poziom cfDNA był również znacząco wyższy u kobiet w ciąży i u osób z masywnym stanem zapalnym [2]. Badania publikowane w kolejnych latach potwierdzały nie tylko zjawisko uwalniania cfDNA do krwi obwodowej z komórek guza, ale również ich całkowitą zgodność na poziomie genetycznym i cytogenetycznym z DNA izolowanym bezpośrednio z tkanki nowotworu. Od tego momentu krążącą frakcję cfDNA przyjęto nazywać ctDNA.
Istnieje szereg hipotez dotyczących sposobu uwalniania ctDNA przez komórki guza do krwi obwodowej. Pomimo, że proces ten nie został jeszcze w pełni poznany uważa się, że kluczową rolę ogrywają trzy mechanizmy: nekroza, apoptoza oraz aktywne wydzielanie ctDNA przez komórki nowotworowe.
O prognostycznej roli ctDNA u chorych na chłoniaka rozlanego z dużych limfocytów B (DLBCL, ang. diffuse large B-cell lymphoma) wiemy już od dłuższego czasu. Ocena ctDNA stała się możliwa dzięki rozwojowi innowacyjnych technik takich jak sekwencjonowanie nowej generacji (NGS, ang. next generation sequencing). Pierwsze publikacje na ten temat pojawiły się w 2015 roku [3]. Już wtedy zaobserwowano, że wysokie lub wykrywalne ctDNA po 2. lub 3. cyklach leczenia ma istotne statystycznie znaczenie prognostyczne. W ostatnich latach wielu badaczy skupia się na opracowaniu najlepszej i najdokładniejszej metody do oceny ctDNA u chorych na chłoniaka DLBCL [4].
W dniach 10-13 grudnia 2022 roku odbył się 64. zjazd Amerykańskiego Towarzystwa Hematologów (ASH, ang. American Society of Hematology), na którym przedstawiono dwa bardzo interesujące doniesienia ustne dotyczące oceny ctDNA u chorych na chłoniaka DLBCL.
Pierwsza praca zaprezentowana przez Roschewski i wsp. oceniała minimalną chorobę resztkową (MRD, ang. minimal residual disease) za pomocą nowej metody - face variant enrichment and detection, która pozwala na wykrycie zmutowanych alleli już na poziomie 10-6 [5]. Autorzy przebadali 112 chorych włączanych do różnych randomizowanych badań prospektywnych, u których był dostępny materiał histopatologiczny przed rozpoczęciem leczenia. ctDNA było oceniane po 1., 2. i 3. cyklu leczenia, oraz co najważniejsze, po zakończeniu terapii. U chorych u których nie obserwowano progresji choroby lub zgonu związanego z progresją chłoniaka DLBCL, minimalizowały się wartości MRD po 1. cyklu (u 26%), a po zakończonym leczeniu aż u 91% pacjentów (rycina 1A). Niewykrywalne ctDNA po 3. cyklu leczenia okazało się być istotnym statystycznie czynnikiem prognostycznym w odniesieniu do przeżycia wolnego od progresji (PFS, ang. progression free survival). Dodatkowo ci pacjenci mieli prawie 16 razy mniejsze ryzyko progresji choroby bądź zgonu. Co istotne u wszystkich pacjentów MRD-ujemnych nie obserwowano progresji choroby (p<0.001) (rycina 1B).
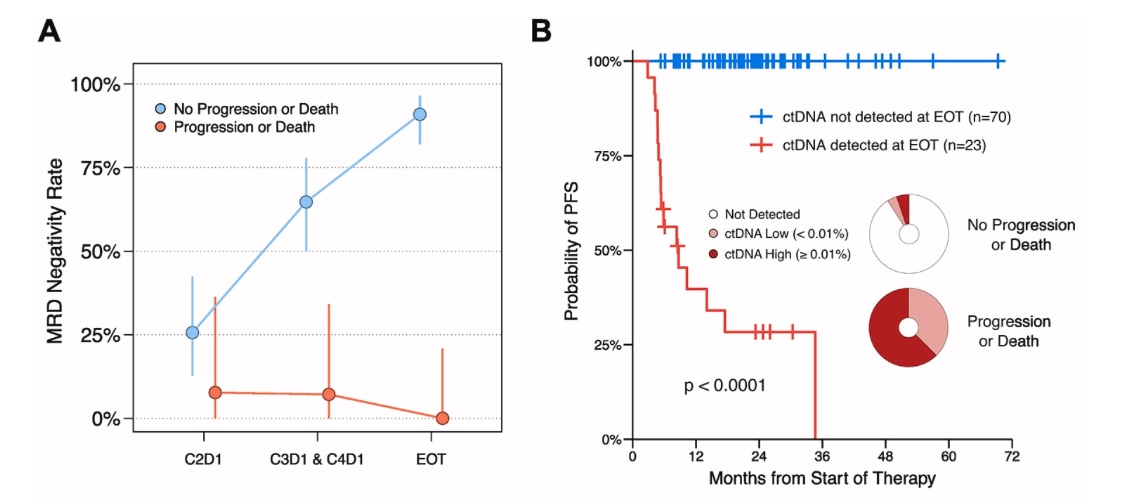
Ryc. 1. Żródło: Roschewski M, Kurtz DM, i wsp. ASH 2022, Abstract 322
Inny rodzaj podejścia do oceny ctDNA został zaprezentowany w drugiej ustnej prezentacji przez badaczy grupy POLARIX [6]. W badaniu tym zastosowano polatuzumab wedotyny w połączeniu z immunochemioterapią RCHP (rytuksymab, cyklofosfamid, prednizon), w porównaniu do standardowej immunochemioterapii RCHOP (rytuksymab, cyklofosfamid, doksorubicyna, prednizon). Leczenie to znacząco wydłużyło PFS u nieleczonych chorych z DLBCL pośredniego i wysokiego ryzyka przy podobnym profilu bezpieczeństwa. W wykonanej subanalizie tego badania autorzy posłużyli się metodą cap sequencing do oceny ctDNA przed rozpoczęciem leczenia oraz po zakończeniu 1. cyklu leczenia (C2D1). W badaniu zaobserwowano, że wysoki (powyżej mediany) poziom ctDNA korelował z wysokim międzynarodowym wskaźnikiem prognostycznym (IPI ang. international prognostic index), z gorzej rokującym podtypem molekularnym ABC (ang. activeted B-cell like), ze stanem sprawności według ECOG>1 oraz z masywną zmianą węzłową (tzw. chorobą bulky). Dodatkowo zaobserwowano, że wysokie poziomy ctDNA były niezależnym czynnikiem prognostycznym w całej populacji chorych w odniesieniu do PFS oraz do całkowitego przeżycia (OS, ang. overall survival) (rycina 2). Również redukcja ctDNA po 1. cyklu leczenia o 2 logarytmy okazała się być niezależnym czynnikiem prognostycznym w odniesieniu do OS i PFS. Autorzy dokonali również oceny w ramieniu chorych, którzy otrzymywali polatuzumab wedotyny. Redukcja ctDNA po 1. cyklu leczenia o 2.5 logarytmu w tej grupie chorych miała najsilniejsze znaczenie prognostyczne w odniesieniu do PFS, jak i OS.
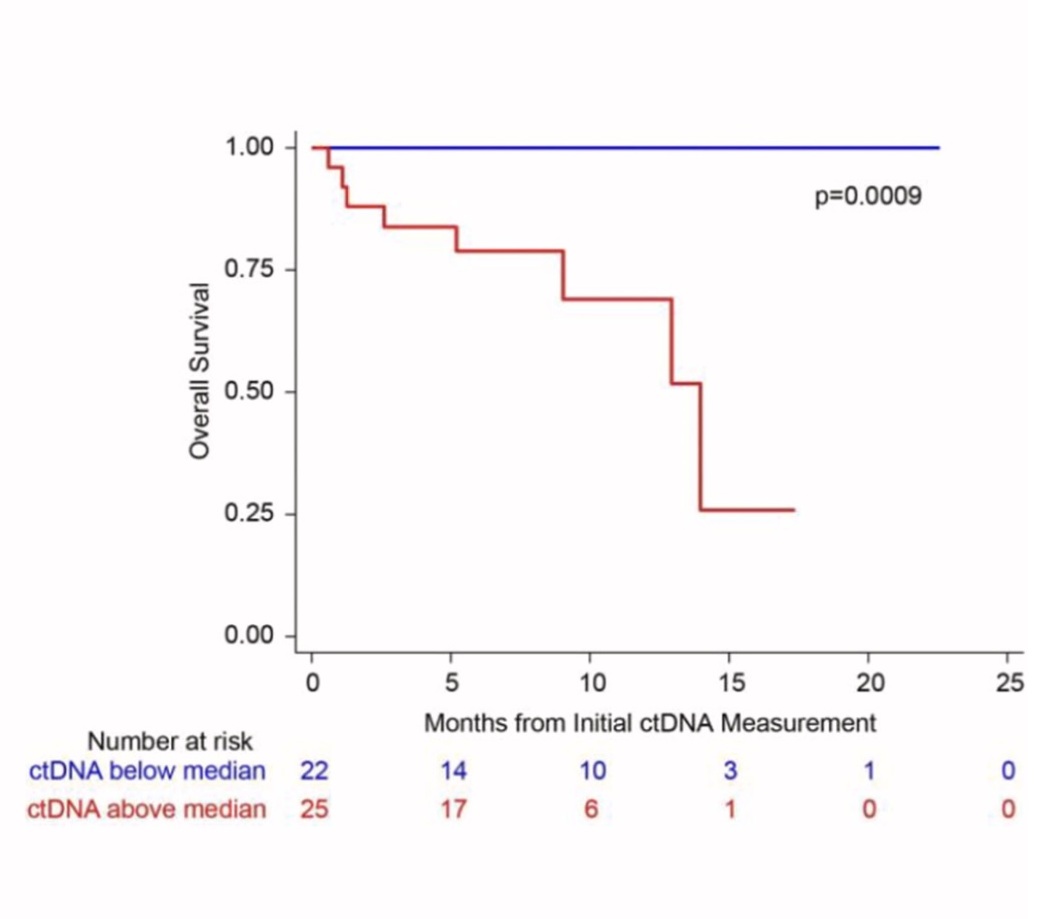
Ryc. 2. Żródło: Herrera AF, McCord R, i wsp. ASH 2022, Abstract 542
Obie przedstawione prezentacje podkreślają silne znaczenie prognostyczne ctDNa u chorych na chłoniaka DLBCL. Być może w niedalekiej przyszłości sekwencjonowanie i monitorowanie ctDNA będzie można zintegrować z przebiegiem leczenia pacjentów z rozpoznaniem chłoniaka DLBCL. ctDNA może pomóc klinicystom w podjęciu decyzji o czasie trwania i sile immunochemioterapii, której chory będzie potrzebował w oparciu o poziomy ctDNA w trakcie leczenia.
Piśmiennictwo:
- Mandel P, Metais P. Les acides nucleiques du plasma sanguine chez l’Homme. Compates Rendus des Seances de la Societe de Biologie et de ses Filiales. 1948;142:241-243.
- Leon SA, Shapiro B, i wsp. Free DNA in the serum of cancer patients and the effect of therapy. Cancer Res 1977;37:646.
- Roschewski M, Dunleavy K, i wsp. Circulating tumour DNA na CT monitoring in patients with untreated diffuse large B-cell lymphoma:
a correlative biomarker study. Lancet Oncol. 2015; 16:541-549.
- Kurtz DM, Scherer F, i wsp. Circulating tumor DNA measurements as early outcome predictors in diffuse large B-cell lymphoma. J Clin
Oncol. 2018;36:2845–53.
- Roschewski M, Kurtz DM, i wsp. MRD-negativity as a potential surrogate endpoint after frontline DLBCL therapy: pooled analysis of
trails and implications for clinical trial design.
ASH 2022, Abstract 322 (https://ash.confex.com/ash/2022/webprogram/Paper167936.html).
- Herrera AF, McCord R, i wsp. Risk profiling of patients with previously untreated diffuse large B-cell lymphoma by measuring circulating
tumor DNA: results from the POLARIX study.
ASH 2022, Abstract 542 (https://ash.confex.com/ash/2022/webprogram/Paper157559.html).
O autorze:

dr n. med. Magdalena Witkowska
Specjalista chorób wewnętrznych i hematologii, adiunkt w Klinice Hematologii UM w Łodzi. Jest autorem lub współautorem wielu publikacji z zakresu hematologii oraz autorem rozdziałów w podręcznikach. Członek Polskiego Towarzystwa Hematologów i Transfuzjologów (PTHiT) oraz Europejskiego Towarzystwa Hematologicznego (EHA). W głównym kręgu jej zainteresowań znajdują się chłoniak Hodgkin’a oraz chłoniaki agresywne B- komórkowe.



